HistoSonics的Edison組織摧毀術系統透過未滿足臨床需求授權獲得英國早期市場准入
HistoSonics的Edison組織摧毀術系統透過未滿足臨床需求授權獲得英國早期市場准入
非侵入性肝腫瘤治療透過英國的創新器材准入路徑(IDAP)獲得肯定
明尼亞波里斯--(BUSINESS WIRE)--(美國商業資訊)-- HistoSonics今日宣布,其用於非侵入性破壞肝腫瘤的Edison組織摧毀術系統已透過未滿足臨床需求授權(UCNA)在英國獲得受控早期有限市場准入。這一認定透過英國的創新器材准入路徑(IDAP)計畫頒發,允許特定肝腫瘤病患在受控條件下提早使用組織摧毀術,代表英國在擴大腫瘤領域最緊迫未滿足醫療需求的治療方案方面實現了重要的里程碑。
英國政府推出的IDAP計畫旨在協助加快變革性醫療技術進入醫療體系。鑑於組織摧毀術在有效解決英國目前及未來核心醫療需求方面的潛力,Edison系統被選為2024年僅有的8個申請名額之一。經過嚴格的評估流程,英國醫療器材主管機關——英國藥品和健康產品管理局(MHRA)認定,我們的組織摧毀術器材可透過UCNA通路供應,強調其為原發性或轉移性肝腫瘤病患可能帶來的重要公共衛生價值。
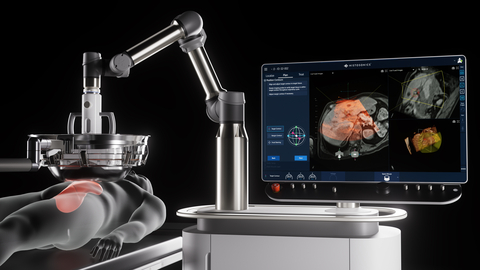
Edison系統是首款且唯一採用組織摧毀術的平台。這一非熱、非侵入性聚焦超音波技術可透過機械作用液化腫瘤,無需手術、放療或全身治療。該器材於2023年10月獲得美國食品藥物管理局(FDA)的De Novo認證。HistoSonics平台獨有的技術使醫生能夠透過持續即時視覺化和控制,完成腫瘤破壞的規劃、靶向、治療及監測,提供現有任何療法均無法企及的精準控制能力。
HistoSonics總裁兼執行長Mike Blue表示:「透過IDAP試點計畫獲得英國受控准入,對於HistoSonics而言是一個重大的里程碑,顯示我們的技術在變革醫療領域方面的潛力獲得明確肯定。我們很榮幸能與英國國民保健署(NHS)及英國監管和准入合作夥伴合作,將組織摧毀術帶給全英國的病患,其中許多人目前的治療選擇有限。這一進展建立在我們在美國強大的臨床記錄和全球與日俱增的臨床證據基礎之上。」
繼2023年10月獲得FDA的De Novo認證後,Edison系統已在美國主要學術中心和醫院投入使用,包括綜合醫療系統和社群醫院,它們也迫切希望為病患提供這種突破性的非侵入性治療。目前,公司正展開更多臨床試驗以擴充組織摧毀術的適應症,包括針對腎腫瘤(HOPE4KIDNEY試驗NCT05820087)和胰腺腫瘤(GANNON試驗NCT06282809)的非侵入性治療,為這兩項適應症的監管申報做準備。
公司相信,透過前幾年在肝臟和腎臟領域展開的多項開創性臨床試驗,其在英國建立的牢固臨床合作關係將有助於加快組織摧毀術在英國主要醫療中心的普及。
根據UCNA授權,HistoSonics將與MHRA合作評估病患預後,並定期蒐集和分析器材效能與安全性的真實世界資料,此為上市後監測計畫的一部分。同時,公司正透過歐洲合格認證流程(CE認證)尋求歐洲監管核准,這將使其在英國和歐洲實現更廣泛的商業化應用。
英國預期用途說明:
Edison系統用於對肝腫瘤進行非侵入性機械破壞,包括透過組織摧毀術對無法切除的肝臟腫瘤進行部分或完全破壞。這包括與原發性肝癌相關的惡性腫瘤以及肝臟轉移性疾病病例。該器材只能由已完成HistoSonics Inc.培訓的人員使用,並且其使用應遵循經過適當培訓的醫生的臨床判斷。使用者必須閱讀使用者指南,瞭解警告、注意事項和臨床試驗總結(包括報告的不良事件)。
Edison系統尚未針對任何特定疾病(包括但不限於癌症)的治療效果或任何特定癌症預後(如局部腫瘤進展、5年存活期或總存活期)進行評估。
美國預期用途說明:
Edison系統用於對肝腫瘤進行非侵入性機械破壞,包括透過組織摧毀術對無法切除的肝臟腫瘤進行部分或完全破壞。FDA尚未針對任何疾病(包括但不限於癌症)的治療效果或任何特定癌症預後(如局部腫瘤進展、5年存活期或總存活期)對Edison系統進行評估。該系統只能由已完成HistoSonics培訓的醫生使用,並且其使用應遵循經過適當培訓的醫生的臨床判斷。有關警告、注意事項和臨床試驗結果摘要(包括報告的不良事件)的完整列表,請參閱器材使用說明。
HistoSonics 公司概覽
HistoSonics是一家私人醫療器材公司,利用組織摧毀術開發非侵入性平台和專有聲束療法。組織摧毀術是一種利用聚焦超音波以機械方式破壞和液化多餘組織和腫瘤的新型作用機制。該公司目前的重點是在美國和部分全球市場將其用於肝臟治療的Edison系統商業化,同時將組織摧毀術的應用擴充到腎臟、胰腺等其他器官。HistoSonics在密西根州安娜堡和明尼蘇達州明尼亞波里斯設有辦事處。如欲瞭解有關Edison組織摧毀術系統的更多資訊,請造訪: www.histosonics.com/ 。如欲瞭解病患相關資訊,請造訪: www.myhistotripsy.com/ 。
Ziemlewicz等發表在《外科學年鑒》上的《#HOPE4LIVER單臂關鍵試驗:組織摧毀術治療原發性和轉移性肝腫瘤的一年期臨床結果更新》一文遵循CC BY-NC-ND授權協議。
免責聲明:本公告之原文版本乃官方授權版本。譯文僅供方便瞭解之用,煩請參照原文,原文版本乃唯一具法律效力之版本。
Contacts
媒體查詢
媒體連絡人:
Josh King
行銷副總裁
電子郵件:Joshua.king@histosonics.com
電話:608.332.8124
Kimberly Ha
KKH Advisors
917-291-5744
kimberly.ha@kkhadvisors.com